Investigation
Una agrupación de proteínas en las mitocondrias del músculo esquelético mejora la eficiencia bioenergética
Investigadores del Centro de Biología Molecular Severo Ochoa (SBMSO), la Universidad Autónoma de Madrid (UAM) y el Consejo Superior de Investigaciones Científicas (CSIC) han descubierto un supercomplejo de tres proteínas hasta ahora no relacionadas entre sí. Los resultados, publicados en Nature Metabolism, describen cómo estas proteínas se asocian en las mitocondrias del músculo esquelético para mantener la eficiencia bioenergética. Este descubrimiento podría tener implicaciones en la comprensión y tratamiento de diversas enfermedades relacionadas con alteraciones en la funcionalidad mitocondrial.
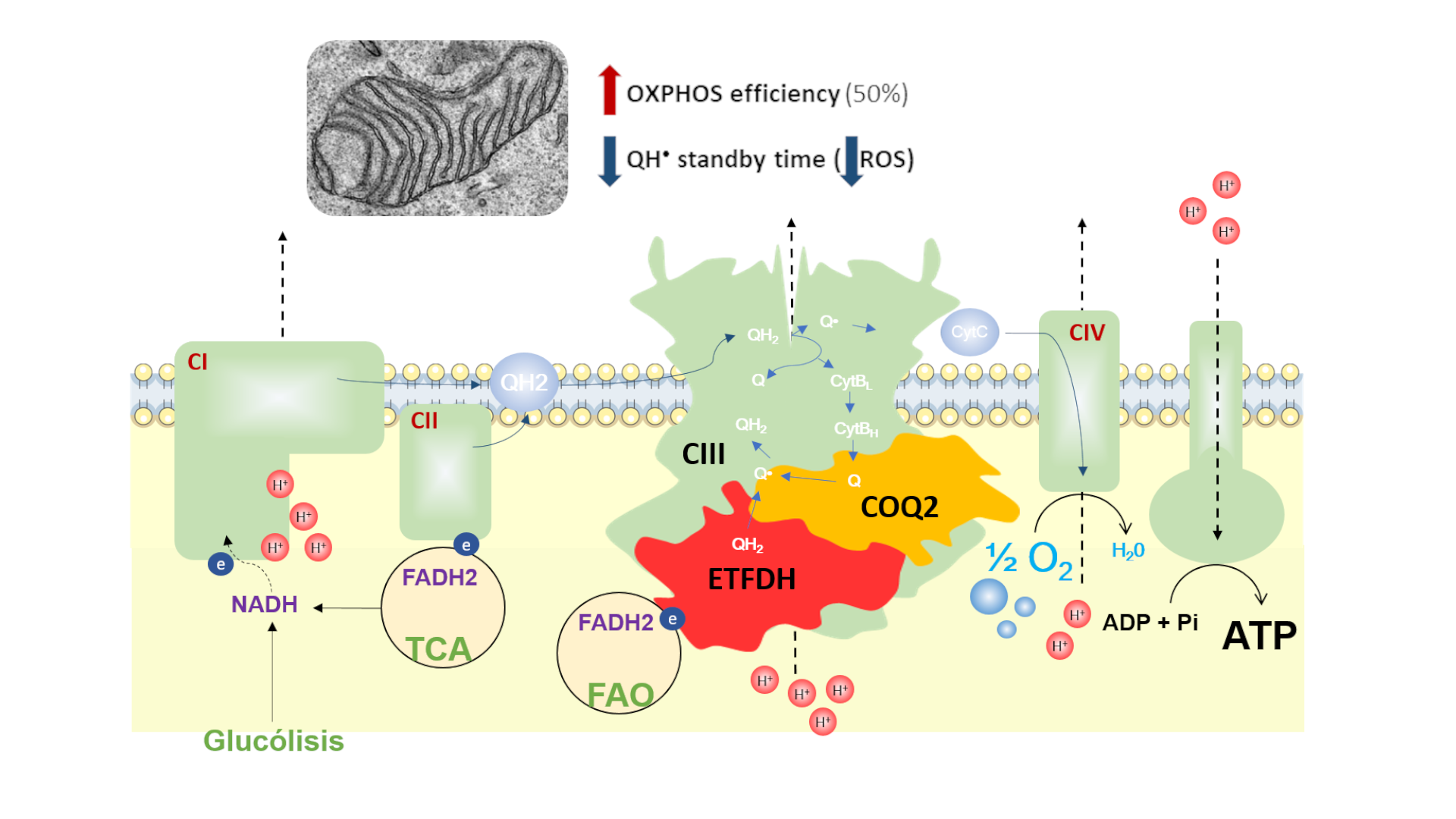
El nuevo “metabolon” identificado en las mitocondrias del músculo esquelético y formado por el CIII, ETFDH, y COQ2 se encarga de mantener la eficiencia bioenergética de la fosforilacción oxidativa mitocondrial. / Herrero Martin JC et al., Nat Metab 2024
El grupo de la profesora Laura Formentini, en el Centro de Biología Molecular Severo Ochoa (Centro mixto UAM/CSIC), ha descrito por primera vez cómo tres proteínas mitocondriales, hasta ahora consideradas independientes, se asocian en el músculo esquelético para mejorar la eficiencia energética.
La existencia de este supercomplejo revela un nuevo mecanismo molecular por el cual las mitocondrias en el músculo esquelético se defienden de las especies reactivas del oxígeno, aumentando la eficiencia bioenergética durante la oxidación de sustratos.
De acuerdo con el trabajo, publicado en Nature Metabolism, la primera de dichas proteínas, COQ2, sintetiza la coenzima Q10, una molécula lipofilica encargada de transferir electrones entre distintas proteínas. La segunda, ETFDH, transfiere electrones en la oxidación de ácidos grasos y aminoácidos ramificados a la coenzima Q10. Por último, el complejo mitocondrial III, es una proteína esencial en la utilización de la coenzima Q10 para generar energía celular en el proceso de la fosforilación oxidativa.
“En suma, nuestro hallazgo ofrece una nueva perspectiva en la minimización de la generación de las especies reactivas en el Ciclo Q de la cadena respiratoria. Algo similar ya había sido sugerido por Peter Mitchell, padre de la bioenergética mitocondrial y Premio Nobel en 1978 por formular la Teoría Quimiosmótica”, detalla el coautor Juan Cruz Herrero Martín.
Mitocondrias y supercomplejos
Las mitocondrias son orgánulos celulares esenciales que desempeñan múltiples funciones, incluyendo el metabolismo y la bioenergética. Su función más destacada es proveer energía a las células eucariotas mediante la oxidación de sustratos y el uso del oxígeno como aceptor final de electrones. A pesar de ser necesaria, esta utilización del oxígeno conlleva la producción de especies reactivas de oxígeno, potencialmente dañinas para la célula.
Las mitocondrias intentan minimizar este riesgo formando supercomplejos que optimizan el tránsito de electrones y los protegen del oxígeno. Un supercomplejo, ‘metabolón’, es una agrupación de proteínas que colaboran estrechamente para incrementar la eficiencia en una función específica.
“En particular, el metabolón que hemos descrito subraya la extraordinaria capacidad de nuestras células para adaptarse a cambios ambientales y nutricionales, y para responder a estos cambios encendiendo o apagando las centrales energéticas que aumentan la eficiencia del sistema”, destaca el coautor Beñat Salegi Ansa.
Un interruptor biomolecular estratégico
El músculo esquelético es el órgano oxidativo más grande del cuerpo humano que consume glucosa como substrato principal. Sin embargo, en determinadas condiciones, como durante un ayuno prolongado o en ejercicio leve oxidativo —durante un paseo—, las mitocondrias pasan a oxidar lípidos y aminoácidos ramificados como fuente de energía.
Además, según el tipo de ejercicio —aerobio o anaerobio, explosivo o de resistencia— las mitocondrias se adaptan al cambio de nutrientes que oxidan y, por tanto, a encender o apagar la actividad de este metabolón mitocondrial.
“Faltaba descubrir cuál es el interruptor que promueve ese cambio, que integra la oxidación de ácidos grasos con la eficiente transferencia de electrones en la cadena respiratoria y la biosíntesis de la coenzima Q”, explica Laura Formentini.
“Además —agrega la investigadora—, desde el punto de vista terapéutico, este hallazgo puede ser relevante porque administrar coenzima Q a pacientes con déficit en la oxidación de ácidos grasos puede ser contraproducente, ya que la reducción que se observa de coenzima Q en estos pacientes puede ser un mecanismo de protección frente a la sobreproducción de especies reactivas del oxígeno en el complejo III”.
Por último, este trabajo (financiado por el Plan Estatal y la Fundación Ramón Areces) tiene implicaciones en el campo de la medicina mitocondrial. Las alteraciones en la funcionalidad mitocondrial están asociadas a una amplia gama de enfermedades, incluyendo el cáncer, la diabetes, y trastornos neuromusculares y metabólicos. Este metabolón abre nuevas vías para desarrollar una medicina mitocondrial más refinada y representa una herramienta estratégica en la lucha contra patologías prevalentes.
_____________________
Referencia bibliográfica:
Herrero-Martin JC., Salegi Ansa, B., Álvarez-Rivera, G., Domínguez-Zorita, S., Rodríguez-Pombo, P., Pérez, P., Calvo, E., Paradela, A., G. Miguez, D., Cifuentes, A., Cuezva, J.M., Formentini, L., An ETFDH-driven metabolon supports OXPHOS efficiency in skeletal muscle by regulating coenzyme Q homeostasis Nature Metabolism, 2024. Doi: 10.1038/s42255-023-00956-y.
Más cultura científica en UAM Gazette