Investigación
Potencial diana terapéutica contra tumores hematológicos agresivos
Un estudio de la Universidad Autónoma de Madrid (UAM) ha identificado que la desregulación del gen SOCS3 contribuye a la activación de una vía de señalización celular en tumores hematológicos agresivos. Los resultados, publicados en el British Journal of Haematology, postulan al gen SOCS3 como potencial diana terapéutica en pacientes con estos tipos de cáncer.
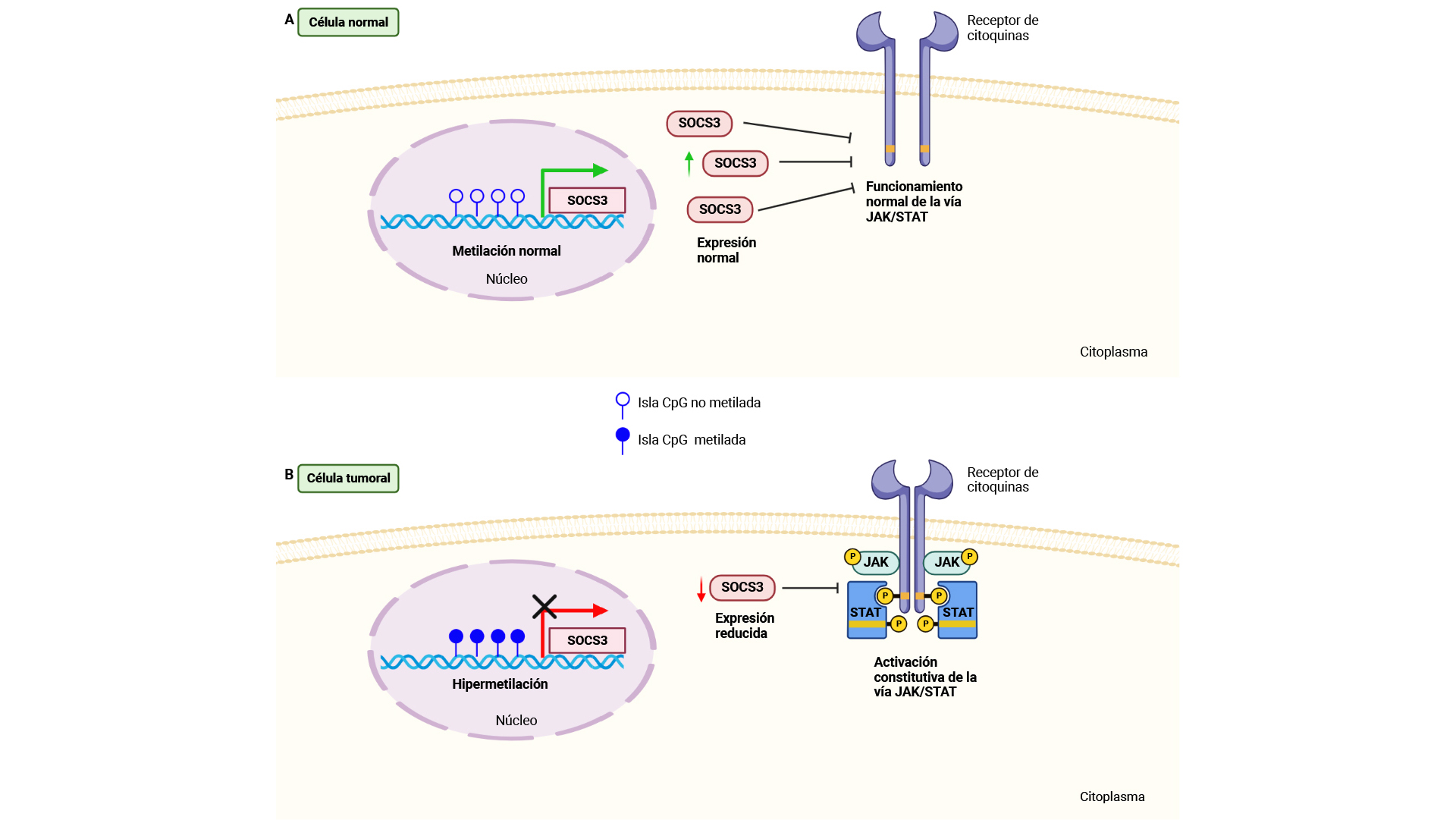
Consecuencias derivadas de la hipermetilación de SOCS3 en T-ALL/LBL. (A) Metilación y expresión de SOCS3 en células normales. (B) La hipermetilación de SOCS3 en las células tumorales contribuye a una expresión reducida de SOCS3 y a una activación constitutiva de la vía JAK/STAT / Lahera et al. - BioRender.com.
Investigadores de la Universidad Autónoma de Madrid (UAM) han identificado la hipermetilación (alteración de carácter epigenético) del gen SOCS3 como un evento frecuente en los tumores hematológicos agresivos conocidos como ‘neoplasias de células T precursoras’, o T-ALL/LBL.
Los resultados, publicados en el British Journal of Haematology, también muestran que una menor expresión de SOCS3 contribuye a la activación constitutiva de la vía de señalización celular JAK/STAT a través de diferentes mecanismos, como un incremento en el potencial oncogénico de algunas mutaciones.
En suma, estos hallazgos revelan la importancia que tiene la desregulación del gen SOCS3 para la activación constitutiva de la vía JAK/STAT, proponiendo a SOCS3 como una potencial diana terapéutica en las T-ALL/LBL.
Las T-ALL/LBL
Las ‘neoplasias de células T precursoras’ son tumores hematológicos agresivos que se originan a partir de linfoblastos comprometidos con el linaje de células T. Estas neoplasias afectan mayoritariamente a la médula ósea y a la sangre, en cuyo caso se denominan leucemia linfoblástica aguda de células T (T-ALL); aunque, de forma menos frecuente, también pueden aparecer como una masa tumoral en el timo/mediastino anterior o en los ganglios linfáticos, y en tal caso reciben el nombre de linfoma linfoblástico de células T (T-LBL).
Si bien los tratamientos actuales para las T-ALL/LBL alcanzan una tasa de curación razonable, la alta toxicidad que llevan asociada y la baja prognosis en caso de recaída (con índices de supervivencia inferiores al 10%) ponen de manifiesto la necesidad de desarrollar nuevas terapias personalizadas que sean más eficaces y presenten menos efectos secundarios.
JAK/STAT es una vía de señalización celular que aparece frecuentemente desregulada en las T-ALL/LBL, puesto que se encuentra activada de una forma constitutiva o permanente y, como resultado, promueve el desarrollo tumoral.
Sin embargo, a día de hoy, no se ha aprobado ninguna terapia personalizada para aquellos pacientes diagnosticados con T-ALL/LBL que presentan una activación constitutiva de la vía JAK/STAT. Por lo tanto, resulta esencial profundizar en las alteraciones moleculares que contribuyen a la activación constitutiva de la vía JAK/STAT y que están presentes en dichos pacientes, con el objetivo de identificar nuevas dianas terapéuticas.
Hipermetilación
Los investigadores de la UAM estudiaron alteraciones de carácter epigenético en el gen SOCS3; es decir, alteraciones que no producen un cambio en la secuencia de nucleótidos del gen pero que son susceptibles de modificar sus niveles de expresión.
Concretamente, estudiaron la metilación del ADN, un tipo de alteración epigenética que consiste en la adición de grupos metilo sobre las citosinas que forman parte de los denominados di-nucleótidos dCpG. Todo con el objetivo de evaluar si una metilación aberrante del ADN podría contribuir a la activación constitutiva de la vía JAK/STAT en las T-ALL/LBL.
“Cuando el proceso de metilación afecta a la región del gen donde se localizan las secuencias reguladoras necesarias para el inicio de la transcripción —explican los investigadores—, tiene como consecuencia una disminución en los niveles de expresión del gen en cuestión, puesto que se dificulta el acceso a la maquinaria encargada de la transcripción del ADN”.
“Este fenómeno de hipermetilación se ha reportado de forma recurrente en las células tumorales, donde afecta a los conocidos como genes supresores de tumores, es decir, aquellos genes que inhiben el desarrollo tumoral”.
“De este modo —concluyen los autores—, una metilación aberrante en los genes supresores de tumores reduciría sus niveles de expresión y, por lo tanto, favorecería la viabilidad y proliferación de las células tumorales”.
Estos resultados han sido fruto de una investigación traslacional (investigación básica aplicada a las primeras fases del desarrollo de un medicamento) llevada a cabo por la UAM y el Hospital Universitario Fundación Jiménez Díaz, con participación del Instituto de Salud Carlos III y del Instituto de Oncología de Asturias.
_____________________
Referencia bibliográfica:
Lahera, A., López-Nieva, P., Alarcón, H., Marín-Rubio, J.L., Cobos-Fernández, M.Á., Fernández-Navarro, P., Fernández, A.F., Vela-Martín, L., Sastre, I., Ruiz-García, S., Llamas, P., López-Lorenzo, J.L., Cornago, J., Santos, J., Fernández-Piqueras, J., Villa-Morales, M. 2023. SOCS3 deregulation contributes to aberrant activation of the JAK/STAT pathway in precursor T-cell neoplasms. British Journal of Haematology. doi: 10.1111/bjh.18694
Más cultura científica en UAM Gazette.