Investigación
Identifican una proteína clave para la eficacia de la respuesta inmune
Investigadores de la Universidad Autónoma de Madrid (UAM) y el CSIC han identificado a la proteína FMNL1β como pieza clave en la secreción dirigida de vesículas en células T. El hallazgo, publicado en ‘eLife’, podría mejorar el diseño de inmunoterapias como las CAR-T al revelar un nuevo mecanismo que regula la eficacia de la respuesta inmune en la sinapsis inmunitaria. La importancia del estudio ha sido reconocida con su inclusión en la portada en la revista Inmunología (Vol. 44, Núm. 1, mayo 2025), publicación oficial de la Sociedad Española de Inmunología (SEI)
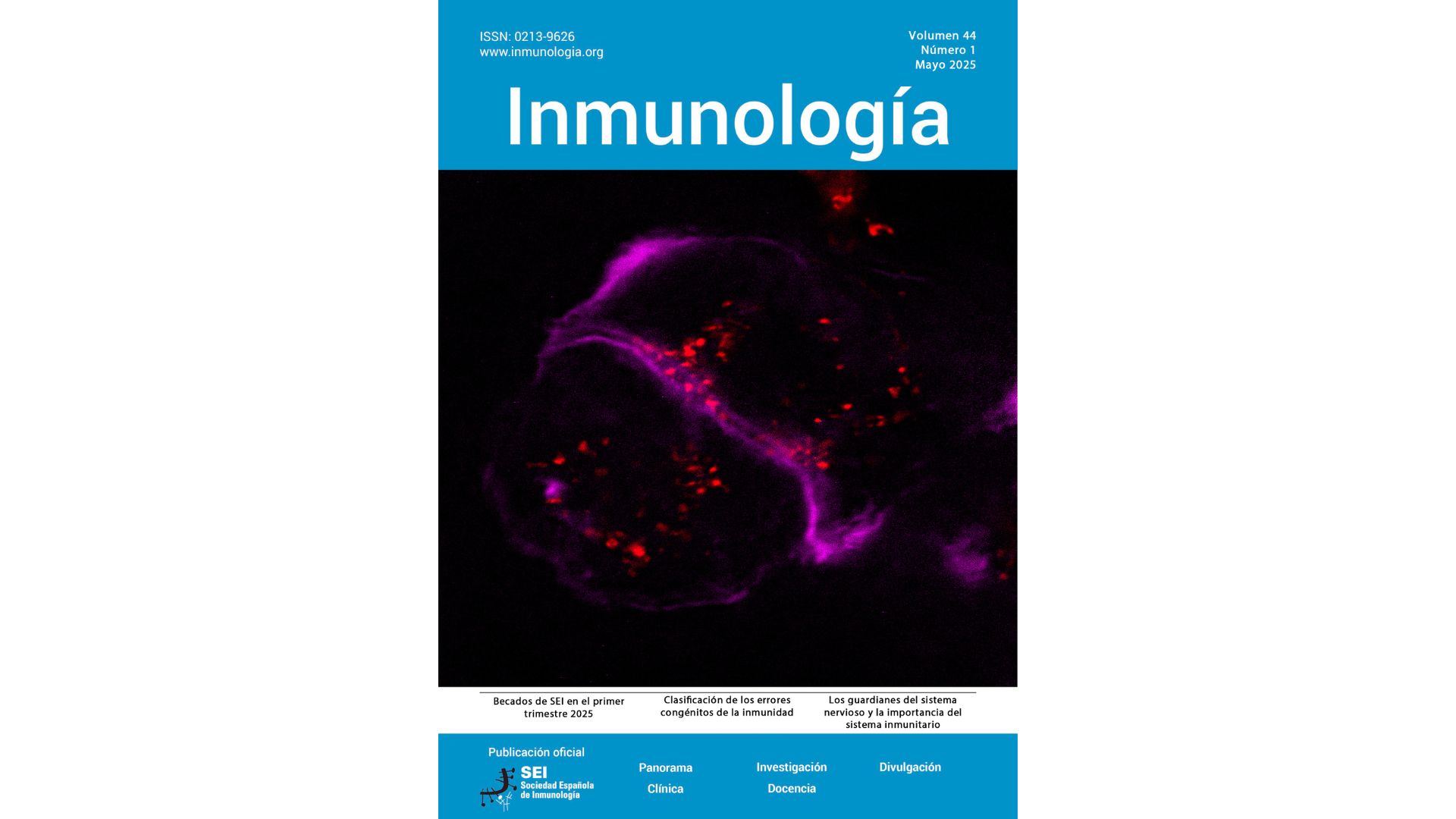
Imagen de microscopía confocal de super-resolución que ilustra la reorganización del citoesqueleto de actina (magenta) y la localización de nanovesículas (rojo) durante la sinapsis inmunitaria / Portada de la revista científica Inmunología (Vol. 44, Núm. 1, mayo 2025)
Un equipo del Instituto de Investigaciones Biomédicas Sols-Morreale (centro mixto UAM-CSIC) ha identificado un mecanismo esencial en la comunicación entre los linfocitos T y otras células del sistema inmunitario.
En concreto, el estudio, publicado en la revista eLife, revela que una proteína llamada formin-like 1 beta (FMNL1β) regula de forma crucial la reorganización del citoesqueleto de actina de las células T durante el proceso de activación inmunológica.
Además, la relevancia del hallazgo ha llevado a que la revista Inmunología, publicación oficial de la Sociedad Española de Inmunología (SEI), destaque una entrevista a Javier Ruiz-Navarro, el primer firmante del estudio, en su sección “Visión del Autor”, ocupando la portada de su último número.
La activación de los linfocitos T requiere el establecimiento de una sinapsis inmunitaria, una estructura de contacto altamente organizada que se forma entre el linfocito y una célula presentadora de antígeno (figura de la portada). En este punto de unión, el citoesqueleto celular se reconfigura para permitir la secreción focalizada de exosomas, pequeñas nanovesículas que actúan como mensajeros moleculares y modulan la respuesta inmune.
“Nuestro estudio demuestra que la fosforilación de FMNL1β en el residuo S1086 es indispensable para este proceso. Esta modificación permite que el centrosoma y los cuerpos multivesiculares (MVB) se orienten hacia la sinapsis y liberen exosomas de forma dirigida”, explica Javier Ruiz-Navarro, investigador predoctoral de la UAM y primer firmante del trabajo.
Este hallazgo revela una nueva capa de regulación en la respuesta inmune: sin una correcta modificación de FMNL1β, las células T pierden la capacidad de organizar su citoesqueleto y su maquinaria de secreción para comunicarse eficazmente con otras células. La precisión espacial en la liberación de exosomas es clave para asegurar que la respuesta inmunológica llegue al lugar adecuado y en el momento preciso.
Aplicaciones en inmunoterapia
Los experimentos se realizaron en células Jurkat, un modelo ampliamente utilizado de linfocitos T humanos, pero también en linfocitos primarios extraídos de sangre de donantes sanos y en células CAR-T diseñadas para terapias contra la leucemia. En todos los casos, la falta de fosforilación en FMNL1β impidió la correcta organización del aparato secretor, mientras que una versión fosfomimética de la proteína restauró su funcionalidad.
Gracias al uso combinado de videomicroscopía de célula viva y microscopía de súper-resolución (STED), el equipo logró visualizar en tiempo real la traslocación de FMNL1β a la sinapsis inmunitaria y observar cómo se produce la secreción polarizada de exosomas.
El estudio también revela que, aunque la fosforilación en S1086 es necesaria, no es suficiente por sí sola: en células donde se inhibió la expresión de la quinasa PKCδ, responsable de activar FMNL1β, la secreción polarizada no se restableció, incluso al introducir la variante fosfomimética de la proteína.
“Estos resultados apuntan a que FMNL1β actúa como un interruptor molecular que conecta las señales de activación del receptor T con los mecanismos de secreción de vesículas”, señala Manuel Izquierdo Pastor, investigador del CSIC en el IIBM y director del trabajo. “Comprender este circuito podría ayudarnos a mejorar la eficacia de las terapias celulares, como las CAR-T, que dependen de una respuesta inmunitaria precisa y dirigida”.
El estudio ha contado con la colaboración del grupo de investigación traslacional en oncología pediátrica del Hospital Universitario La Paz y del Centro Nacional de Investigaciones Oncológicas (CNIO), dirigido por el Dr. Antonio Pérez-Martínez, profesor de la UAM, y ha sido financiado por la Agencia Estatal de Investigación y el Instituto de Salud Carlos III.
_____________________
Referencia bibliográfica:
Ruiz-Navarro J, Fernández-Hermira S, Sanz-Fernández I, Barbeito P, Navarro-Zapata A, Pérez-Martínez A, Garcia-Gonzalo FR, Calvo V, Izquierdo-Pastor M. “Formin-like 1β phosphorylation at S1086 is necessary for secretory polarized traffic of exosomes at the immune synapse in Jurkat T lymphocytes”. eLife. 2024,13:RP96942. https://doi.org/10.7554/eLife.96942.4
Enlace a la entrevista:https://revista.inmunologia.org/articulos-actuales/investigacion/investigacion-vision-del-autor-a/v-44-n-1-papel-de-la-formina-fmnl1%CE%B2-en-la-secrecion-polarizada-de-celulas-t-en-la-sinapsis-inmunitaria
Más información: UAM Gazette