Investigación
Nueva isoforma de la Tau humana
Científicos de la Universidad Autónoma de Madrid (UAM) han descubierto una nueva isoforma truncada de la Tau humana, proteína asociada a enfermedades como Alzheimer. Los resultados podrían brindar pistas sobre los mecanismos que contribuyen al desarrollo de patologías neurodegenerativas y señalar potenciales dianas terapéuticas.
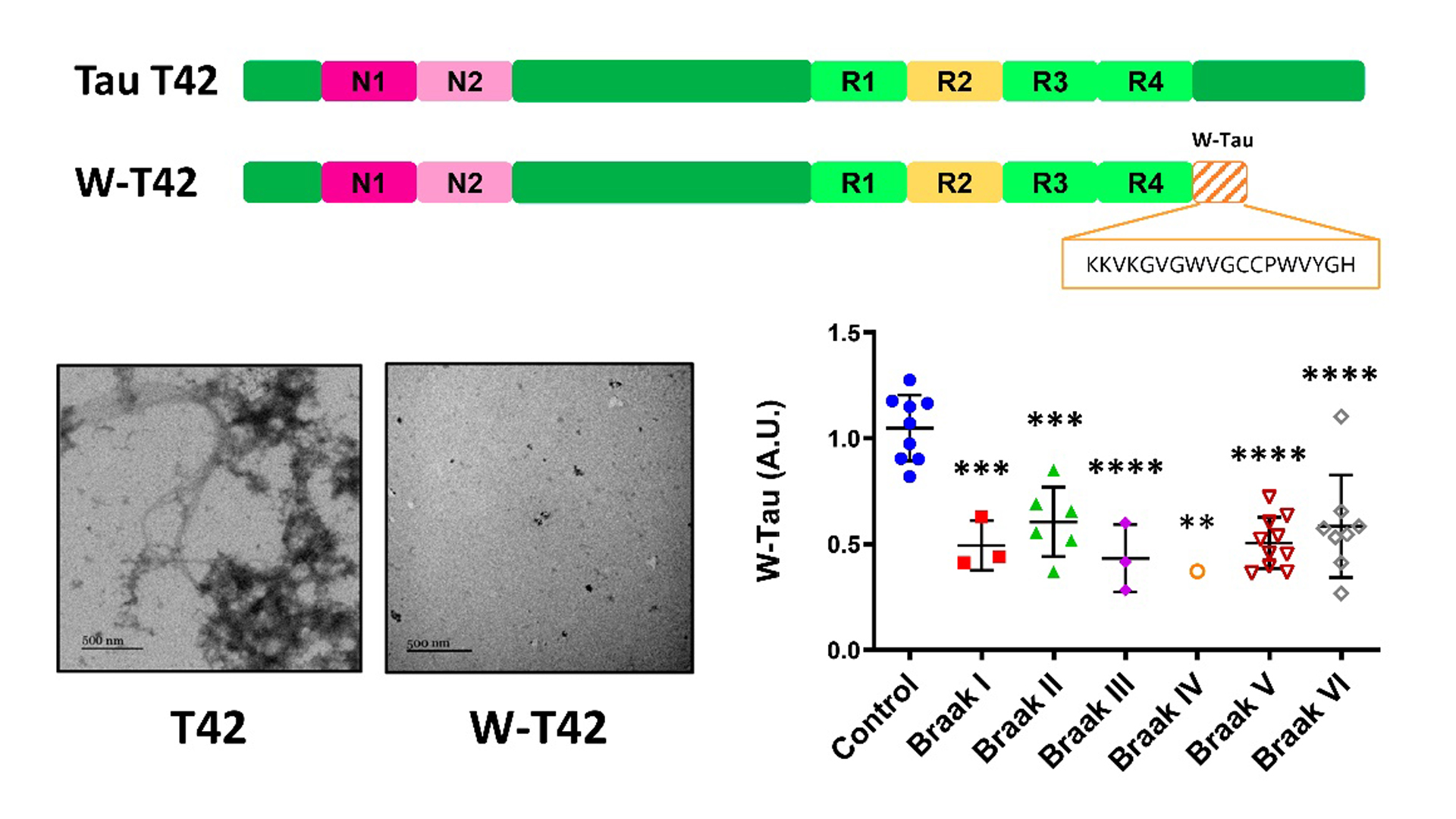
Esquema de la proteína Tau (T42) con 2 insertos N-terminal (N) y 3 repeticiones (R), y la correspondiente isoforma generada por retención intrónica (W-T42), en la que se especifica la secuencia única del péptido W. Se muestran imágenes de agregados proteicos de ambas isoformas de Tau. El gráfico muestra los niveles de la proteína W-Tau en controles y pacientes de Alzheimer clasificados por su estadio de Braak / UAM
Un equipo del Departamento de Anatomía, Histología y Neurociencia de la Universidad Autónoma de Madrid (UAM) ha descubierto una nueva isoforma de la Tau humana, proteína asociada a las llamadas taupatías, enfermedades neurodegenerativas entre las que se encuentra la enfermedad de Alzheimer.
De acuerdo con los resultados, publicados en Acta Neuropathologica, la nueva isoforma se produce mediante un fenómeno de retención intrónica (un tipo de splicing alternativo), considerado relativamente infrecuente en células animales.
Lo anterior, aseguran los autores, da lugar a una proteína truncada que carece del extremo carboxilo terminal normal de Tau, presentando en su lugar una secuencia única de 18 aminoácidos.
En esta secuencia se pueden apreciar dos triptófanos (W), por lo cual los investigadores han bautizado a la isoforma como ‘W-Tau’.
“Lo interesante de W-Tau es que es muestra una capacidad agregativa reducida, mientras que mantiene funciones fisiológicas de Tau, como la capacidad de unión a microtúbulos, y es susceptible de sufrir modificaciones post-traduccionales iguales al resto de isoformas”, explican los autores.
En su trabajo, el equipo describe la presencia de esta isoforma en cerebros humanos, tanto en individuos sanos como en enfermos de Alzheimer, estando significativamente disminuida en estos últimos.
“Esta diferencia, junto a su menor capacidad agregativa y al hecho de que es exclusiva de humanos, apunta a un posible papel relevante de la misma en la aparición y progresión de la enfermedad de Alzheimer”, asegura el equipo.
“Este descubrimiento —agregan— podría darnos pistas sobre los mecanismos que contribuyen al desarrollo de esta patología, y señalaría potenciales dianas terapéuticas para esta enfermedad por el momento incurable”.
El trabajo fue realizado por la Dra. Vega García-Escudero y el doctorando en Neurociencia Daniel Ruiz Gabarre, en un trabajo dirigido por el Prof. Dr. Jesús Ávila (CBMSO-UAM/CSIC), en colaboración con grupos de otras instituciones como el CIEMAT y la Fundación Hospital de Jove.
_____________________
Referencia bibliográfica:
García-Escudero, V., Ruiz-Gabarre, D., Gargini, R., Pérez, M., García, E., Cuadros, R., Hernández, I.H., Cabrera, J.R., García-Escudero, R., Lucas, J.J., Hernández, F., Ávila, J. 2021. A new non-aggregative splicing isoform of human Tau is decreased in Alzheimer's disease. Acta Neuropathologica, doi: 10.1007/s00401-021-02317-z.