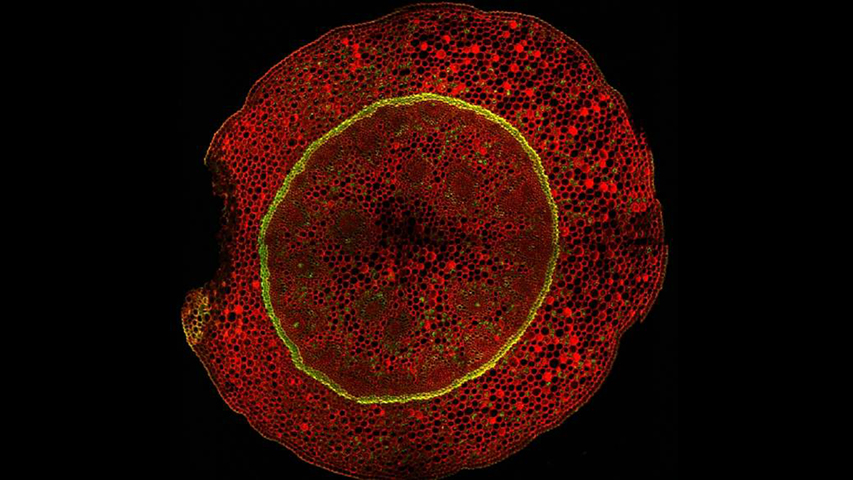
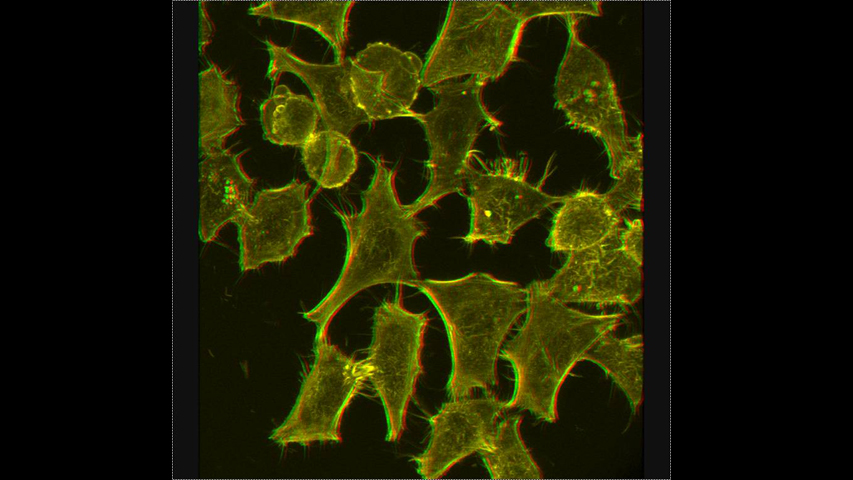
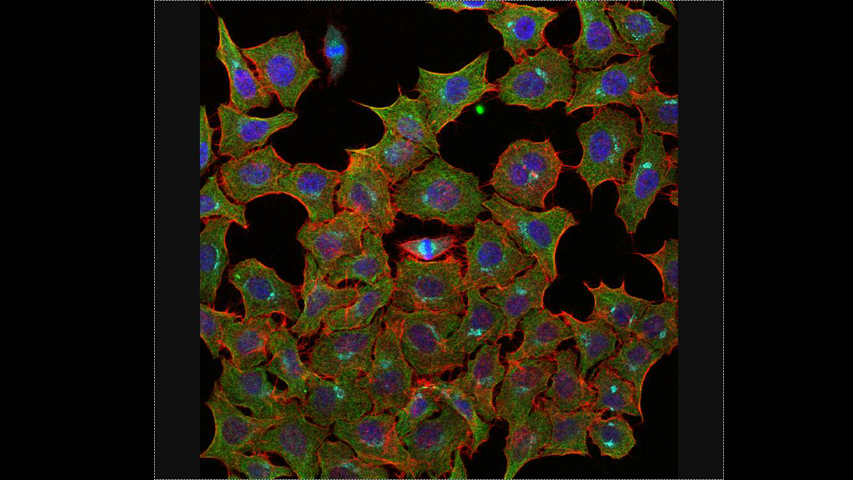
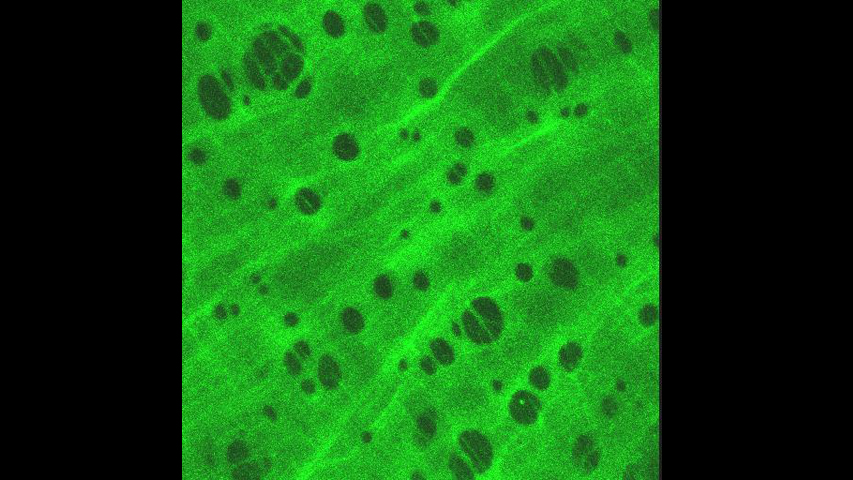
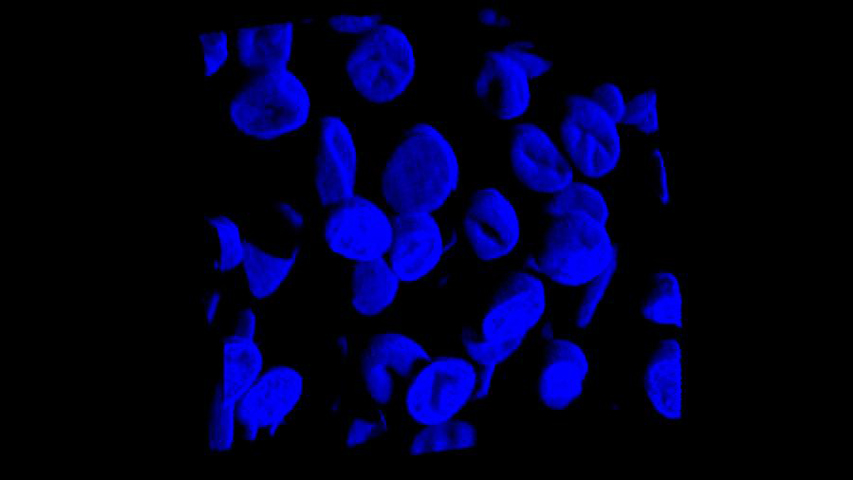
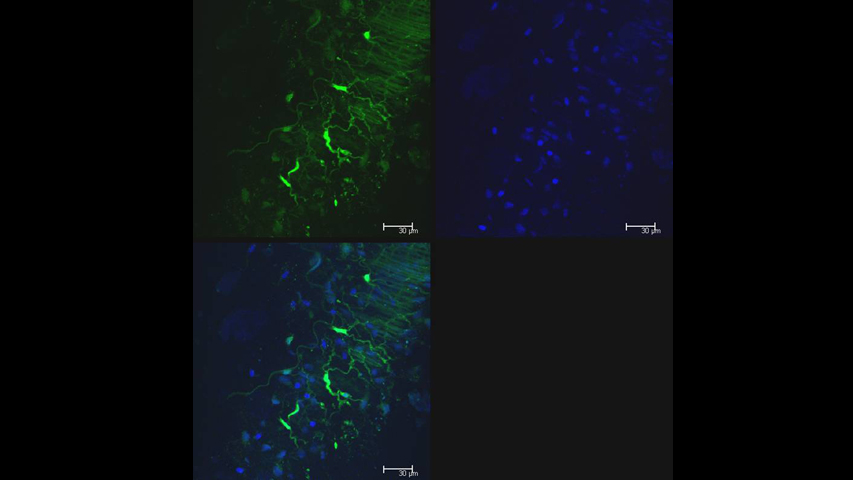
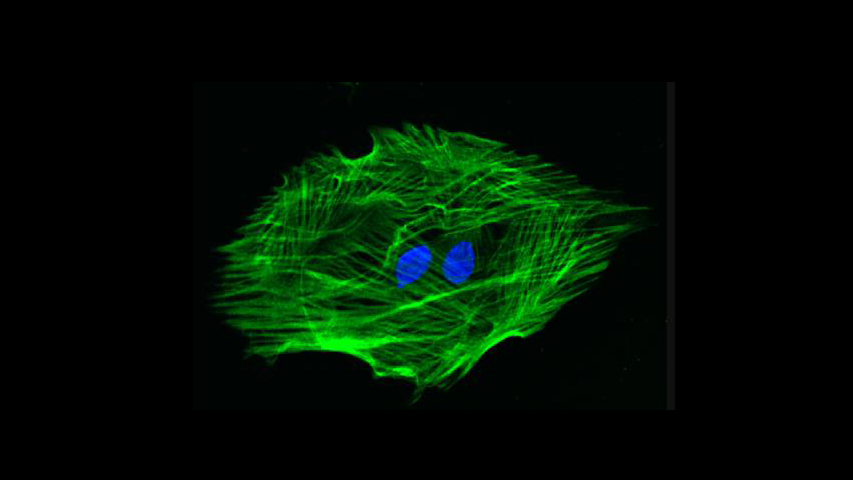
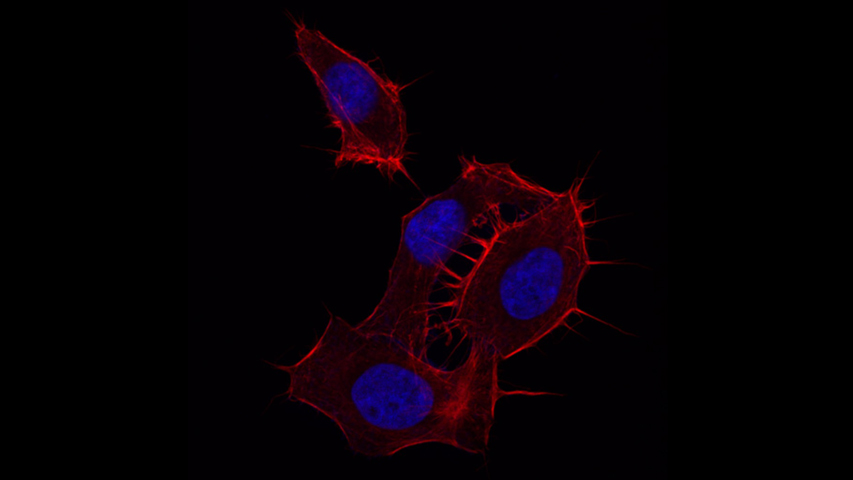
La Microscopía Confocal permite el estudio de muestras con marcaje fluorescente, haciendo secciones ópticas de las mismas y posibilitando su reconstrucción tridimensional.
Principios de la técnica
La característica principal de la Microscopía Confocal es que detecta y recoge la luz emitida por moléculas fluorescentes situadas en un mismo plano focal del espacio tridimensional. Esto es posible porque, por una parte, la fuente de iluminación utilizada es luz láser en la que el haz monocromático se mantiene perfectamente lineal al propagarse. Esta luz ilumina las muestras con una intensidad muy elevada y estable. Esta disposición permite conseguir resoluciones microscópicas subcelulares.
Desde el punto de vista técnico, los microscopios confocales actuales están equipados con una pieza llamada “diafragma de detección confocal” o “pinhole”, que consiste en un pequeño orificio en el filtro detector de la luz que impide el paso de aquella procedente de los planos de la muestra que no están enfocados. Así, se obtiene sólo la información de la región enfocada, denominada “plano de imagen primario” o “plano focal”, y se elimina el resto. Como resultado final se logran imágenes de mucha mejor calidad, pudiéndose realizar cortes virtuales de las muestras analizadas. Esta Microscopía, posibilita el estudio tridimensional de las muestras, incluyendo su interior, y en determinados materiales permite la obtención de imágenes de su superficie mediante reflexión. La Microscopía Confocal también se aplica para el estudio de muestras in vivo a lo largo de una secuencia temporal o para la co-localización de distintos marcadores en una región concreta.
Aplicaciones
- Biología Molecular.
- Biología Vegetal.
- Fisiología.
- Medicina.
- Ciencia de Materiales.
- Microbiología.
- Biología Celular.
- Bioquímica.
- Biomedicina.
- Histología.
- Inmunología.
- Anatomía.
Tipos de ensayo
- Análisis tridimensional de muestras biológicas: inmunofluorescencia en células, tejidos, organismos completos de cierto tamaño, biofilms, etc. Con posibilidad de trabajar las secciones ópticas tanto horizontal (xyz) como verticalmente (xzy).
- Estudios de colocalización de hasta cinco marcadores que emitan en el rango del ultravioleta, visible e infrarrojo. Así como de internalización y tránsito intracelular.
- Análisis de expresión génica, interacción molecular y otros procesos celulares.
- Hibridación in situ con sondas fluorescentes (FISH).
- Experimentos in vivo y a tiempo real mediante marcadores o proteínas de fusión fluorescentes (como por ejemplo, la GFP): Time-lapse, medida de iones intracelulares (análisis fisiológico de Ca2+), estudios en 4D.
- Reconstrucción automática de grandes estructuras a partir de software (experimentos de Tile scan), ya que el equipo dispone de platina motorizada (tanto para experimentos in vivo, como para muestras fijadas).
- Estudios de adquisición simultánea o secuencial de diferentes zonas de la misma muestra o distintos pocillos de una misma preparación en 2D, 3D y 4D (experimentos de Mark and Find y Time-lapse).
- Estudios de lambda scan para la detección espectral lo que permite obtener: las curvas de autofluorescencia de diferentes muestras, los espectros de emisión de los fluoróforos, si se desconocen y, eliminar o minimizar problemas de solapamiento de espectros.
- Estudio de interacciones entre proteínas mediante la técnica FRET (Fluorescence Resonance Energy Transfer). Modos: Acceptor Photobleaching y Sensitized Emission.
- Estudio de transporte de proteínas mediante la técnica FRAP (Fluorescence Recovery After Photo-bleaching) y sus variantes: iFRAP (Inverse), FLIP (Fluorescence Loss in Photobleaching).
- Captación de imágenes con contraste de fase.
- En determinados materiales permite la obtención de imágenes de su superficie mediante reflexión y posterior análisis de superficies, rugosidad, etc.
Funcionamiento del servicio
Es necesario estar dado de alta como usuario del SIdI en la aplicación LIMS para hacer uso de las prestaciones del servicio: efectuar las reservas del microscopio confocal y comprar alícuotas de reactivos fluorescentes y placas disponibles en el laboratorio.
Debe hacerse una reserva previa del tiempo de uso de microscopio poniéndose en contacto directamente con el laboratorio o a través de nuestros calendarios @Lims, dentro de la aplicación LIMS.
Las imágenes adquiridas durante las sesiones pueden descargarse a través de la red (para más información ponerse en contacto con el laboratorio).
Este laboratorio participa activamente en la Red Española de Microscopía Óptica Avanzada (REMOA). Forma parte de la Plataforma de Microscopía para Biociencias de la RedLab de la CAM.
Preparación de muestras
La adquisición de imágenes de alta calidad en microscopía confocal precisa de un procedimiento adecuado y correcto de preparación y montaje de muestras. Este procedimiento abarca una serie de pasos complicados y de larga duración, por lo que, este servicio supone un apoyo al usuario menos experto en estos protocolos o que no disponga del tiempo suficiente para realizarlos, garantizando a su vez, la visualización correcta de las muestras. En general, los protocolos de preparación de muestras para microscopía confocal incluyen los siguientes pasos: disección (y perfusión, en su caso), fijación, marcaje y montaje de las preparaciones.
Equipos
Tarifas
Tarifas vigentes
Área de descargas
Certificado ISO 9001
Laboratorios certificados
Contacta con nosotros
- Técnios de Laboratorio:
Covadonga Aguado Ballano
Paco Urbano
- Responsable Científica del Laboratorio:
Silvia Magdalena Arribas Rodríguez